Fluidoterapia
- Disciplina: Medicina d'urgenza
- Specie: Cane e Gatto
La fluidoterapia consiste nella somministrazione di cristalloidi e colloidi al fine di mantenere o ripristinare l’omeostasi di: acqua, elettroliti, stato acido-base e perfusione. Correggendo gli squilibri sopracitati è possibile trattare e prevenire anche la ridotta disponibilità di ossigeno (DO2). La fluidoterapia può essere utilizzata anche per la sola somministrazione dei farmaci.
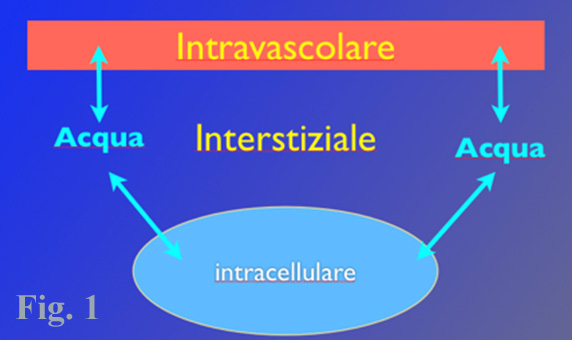
L’acqua a è il solvente nel quale sono disciolti i soluti organici e inorganici e costituisce il 60% del peso corporeo nell’adulto. Il volume totale di acqua presente nell’organismo è definito come TBW (total body water), nei cani e nei gatti sotto i 6 mesi di età la quantità di TBW è ridotta così come nei pazienti obesi, in quanto il tessuto adiposo contiene meno acqua della massa magra. Negli obesi il calcolo del fabbisogno idrico giornaliero dovrebbe essere eseguito sulla massa magra moltiplicando il peso corporeo per 0,7.1La TBW nell’organismo è ripartita in tre compartimenti (Fig. 1):
- intracellulare: 67%;
- interstiziale: 25%;
- intravascolare: 8%.
I fluidi corporei, oltre all’acqua, contengono cationi (sodio, potassio, calcio, magnesio e altri cationi generalmente non misurati), anioni (cloro, bicarbonato e altri anioni generalmente non misurati), proteine, acidi inorganici e sistemi tampone. La distribuzione di questi elementi varia a seconda del comparto (Tab. 1).
|
Ioni |
Fluidi extracellulari (ECF) |
Fluidi intracellulari (IC) |
|
|
Intravascolare Interstiziale |
(mmol/L) |
||
|
CATIONI Na+ K+ Ca2++ (ioniz) Mg2+(ioniz) TOTALE ANIONI Cl- HCO3- HPO4-,H2PO2- proteine- altro TOTALE |
142,0 4,3 2,5 1,1 149,9 104,0 24,0 2,0 14,0 5,9 149,9 |
145,1 4,4 2,4 1,1 153,0 117,4 27,1 2,3 0,0 6,2 153,0 |
12,0 150,0 4,0 34,0 200,0 4,0 12,0 40,0 54,0 90,0 200,0 |
Tabella 1. Distribuzione degli elettroliti nei compartimenti fluidi.
Lo spostamento dell’acqua tra i vari compartimenti è influenzato dal numero di particelle presenti e dalle cariche elettriche che posseggono. Conoscerne la concentrazione nel compartimento extracellulare (ECF = extra cellular fluid) è utile per poter scegliere il fluido più adatto e per facilitarne la diffusione nel compartimento desiderato.
DINAMICA DEI COMPARTIMENTI FLUIDI
La distribuzione dei fluidi nei diversi compartimenti corporei è determinata prevalentemente dall’equilibrio esistente tra tre pressioni: oncotica, osmotica eidrostatica e da altre componenti che regolano il flusso transvascolare come rappresentato nella legge di Starling:
V=[kf(Pc−Pif)−σ(μc −μif)]−Qlinf (1)
(V = volume filtrato; kf = coefficiente di filtrazione; Pc = pressione idrostatica capillare; Pif= pressione idrostatica interstiziale; μc = COP plasma; μif = COP interstiziale; Q = drenaggio linfatico dallo spazio interstiziale e dell’albumina verso la circolazione; σ=diametro dei pori della membrana.)
Dalla formula si comprende come il flusso transvascolare (V), ossia il passaggio di acqua attraverso la parete vasale, dipenda positivamente dalla pressione idrostatica (P) sottratta della pressione oncotica (μ) e incrementa con l’aumentare del coefficiente di filtrazione. La pressione idrostatica può essere valutata indirettamente conoscendo la pressione arteriosa sistemica (BP), incrementi della BP causano un aumento della pressione idrostatica, riduzioni della BP causano riduzioni della P.
La pressione osmotica è la pressione esercitata dal numero di particelle all’interno di una soluzione2, esercita la sua attività per gradiente osmotico, ossia l’acqua per equilibrare il numero di particelle in entrambe i lati della membrana, diffonde dal compartimento a concentrazione inferiore verso il compartimento dove la concentrazione di particelle è superiore. Se si misurassimo il volume di acqua spostato a causa di un aumento o di una diminuzione del numero di particelle si misurerebbe la pressione osmotica. Le molecole responsabili della pressione osmotica hanno piccole dimensioni, quelle generalmente misurate per il calcolo dell’osmolarità sono il sodio, il glucosio e l’urea, come indicato nella seguente formula:
Osmol = 2 x [Na+] + glucosio (mg/dl)/18 + BUN (mg/dl)/2,8 (2)
(Osmol= osmolarità, [Na+] = concentrazione del sodio ematico, BUN= azoto ureico nel sangue.)
La pressione osmotica può essere misurata anche con uno strumento dedicato chiamato osmometro. L’osmometro può essere utile quando si devono trattare gli squilibri del sodio.
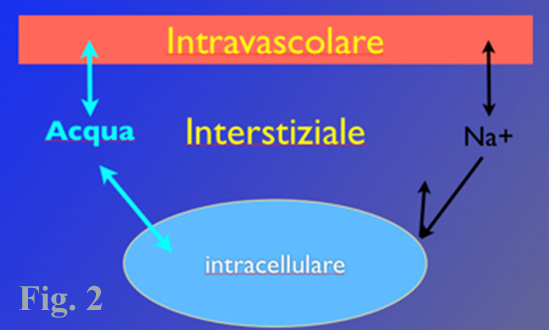
Per la legge dell’azione di massa, l’osmolarità deve essere mantenuta uguale e costante all’interno dei compartimenti acquosi separati da una membrana semipermeabile, un suo incremento è responsabile di un movimento di acqua al suo interno che causa un aumento della pressione. Tale pressione è chiamata osmotica perchè prodotta dai soluti e realizzata dall’acqua. La pressione osmotica dipende dal numero di particelle disciolte, in condizioni di normalità l’osmolarità ematica è pari a circa 300 mOsmol/L. Per tonicità di una soluzione si intende la pressione osmotica di un fluido rispetto al plasma. Ne deriva quindi che una soluzione isotonica presenta un numero di molecole simile a quella del plasma. La somministrazione di un fluido isotonico non produce variazioni di pressione osmotica nel plasma. Il sodio, come indicato nella formula n. 2 è la molecola che maggiormente contribuisce all’aumento della pressione osmotica e quella contenuta in maggior quantità nei fluidi extracellulari (intravascolare e interstiziale), per questo motivo è lo ione che possiede la maggior concentrazione nelle soluzione elettrolitiche bilanciate. Il sodio come le altre molecole di piccole dimensioni attraversa liberamente le pareti dei capillari, trascinando con sé l’acqua presente nel distretto intravascolare, questo fenomeno contribuisce alla fuoriuscita dell’acqua dal compartimento intravascolare verso quello extravascolare. Il sodio non può attraversare liberamente la parete cellulare, in quanto la sua concentrazione all’interno della cellula è regolata dalla pompa sodio potassio (Fig. 2).
Le soluzioni ipotoniche (non bilanciate) hanno un numero di particelle osmoticamente attive inferiore a quello del plasma. Dopo una loro somministrazione per via endovenosa o intraossea, si verifica una riduzione della pressione osmotica nel sangue ed un rapido passaggio di acqua libera verso lo spazio extravascolare, un eccesso di somministrazione di soluzioni ipotoniche può causare edema tessutale. Le soluzioni ipotoniche sono utilizzate per somministrare rapidamente acqua libera. Le soluzioni ipertoniche, viceversa, producendo un aumento della pressione osmotica attraggono verso il compartimento intravascolare l’acqua presente nei compartimenti interstiziale e intracellulare, procurando un’espansione rapida del circolo. Le soluzioni ipertoniche non possono essere somministrate per via sottocutanea. Maggiore è la tonicità della soluzione maggiore sarà la quantità di acqua spostata e più veloce sarà il suo passaggio verso il compartimento intravascolare. L’effetto delle soluzioni ipertoniche saline è transitorio e si esaurisce nell’arco di 2-4 ore in quanto la ridistribuzione dell’acqua e degli elettroliti avviene rapidamente.
Sfruttando la pressione osmotica dei fluidi è perciò possibile scegliere il compartimento che si vuole idratare. Il ripristino del normale volume idrico in un particolare compartimento si chiama reidratazione, un suo eccesso è chiamato edema. Quando è necessario reidratare lo spazio extravascolare è necessario somministrare cristalloidi in quanto dopo circa 1 ora l’80% del fluido somministrato si ridistribuisce nei compartimenti interstiziale e intracellulare. Le soluzioni cristalloidi se somministrate rapidamente espandono anch’esse il circolo ma solo temporaneamente (l’effetto di espansione dura circa 20 minuti - 1 ora) in quanto l’acqua in esse contenuta diffonde liberamente attraverso la parete vascolare. Il glucosio, anch’esso osmoticamente attivo anche se meno efficace del sodio, è presente in numerosi cristalloidi, la sua attività osmotica è molto limitata nel tempo in quanto è scisso rapidamente in acqua e anidride carbonica. Quando lo si somministra in acqua al 5% equivale alla somministrazione di acqua libera con rischio di edema tissutale soprattutto se la soluzione è somministrata in quantità eccessive. Il glucosio può essere utile quando è necessario somministrare farmaci con la fluidoterapia senza causare un aumento della tonicità ematica; l’ipertonicità può causare una aumento della pressione arteriosa quale si riscontra ad esempio in corso di insufficienza cardiaca congestizia, in tali casi per ridurre la tonicità della soluzione è possibile somministrare una soluzione allo 0,45% di NaCl + 2,5% di glucosio. La somministrazione di soluzioni glucosate ad alta concentrazione (30-50%) causano una rapida e transitoria espansione del circolo (circa 20 minuti), anche il glucosio contenuto nelle soluzioni ad alta concentrazione è metabolizzato molto rapidamente, una loro eccessiva somministrazione oltre all’iperglicemia può causare edema tissutale come le sue soluzioni isotoniche al 5%. La soluzione è stabilizzata con acido cloridrico ed il suo pH è di circa 5,4.
La pressione oncotica (COP) é la pressione esercitata nel compartimento intravascolare da molecole che non attraversano la parete capillare se non dopo loro degradazione. Anche la COP contribuisce alla ridistribuzione dell’acqua tra i compartimenti fluidi. Le molecole responsabili della COP sono le proteine contenute nel plasma, la cui maggior componente è l’albumina che da sola contribuisce per circa il 70% della COP. Anche alcuni amidi quali ad esempio gli amidi idrossietilici e i destrani possono esercitare una pressione oncotica positiva. Le molecole osmoticamente attive contribuiscono allo spostamento dell’acqua all’interno del compartimento intravascolare per effetto della legge d’azione di massa, che come nel caso della pressione oncotica, mantiene in equilibrio le particelle presenti ai lati della membrana. Le soluzioni acquose con una elevata COP chiamate soluzioni colloidali o colloidi, espandono rapidamente il circolo innalzando la COP ematica. La riduzione della COP incrementa il passaggio di acqua dallo spazio intravascolare verso quello extravascolare con rischio di edema tissutale.
I colloidi non possono essere somministrati per via sottocutanea ma solo per via endovenosa o intraossea. La loro somministrazione lenta, in CRI (CRI= infusione a velocità costante) a 1-2 ml/kg/ora, è sfruttata per mantenere la COP nell’intervallo di normalità in corso di ipoprotidemie (ad es. enteropatie proteino-disperdenti). La COP in condizioni normali è di circa 20-25 mmHg, quando la concentrazione di albumina sierica scende al di sotto dei 2,0 g/dl o le proteine totali sono inferiori a 5,0 g/dl è necessario considerare la somministrazione di colloidi in CRI o in infusione rapida (boli 5-20 ml/kg/ev in 15-20 minuti). I colloidi per svolgere la loro attività, devono contenere molecole di dimensioni maggiori di 35.000 Dalton così che non possano attraversare la parete vasale. I colloidi cosiddetti iso-oncotici hanno una pressione oncotica pari a quella del plasma (ad es. albumina 5%) quelli iper-oncotici hanno una COP maggiore (ad es. albumina al 25%). La somministrazione dei colloidi iperoncotici incrementa la COP molto rapidamente ed attraggono l’acqua nel comparto intravascolare altrettanto molto rapidamente; il loro impiego deve esser effettuato sotto stretto monitoraggio emodinamico e nel caso dell’albumina il paziente deve essere monitorato anche per le possibili reazioni allergiche che una soluzione ad alta concentrazione può causare.2 I colloidi sono utilizzati prevalentemente per espandere rapidamente il circolo, per ripristinare la COP ed il flusso transvascolare (TER). Il TER governa il movimento di albumina tra lo spazio intravascolare e quello intravascolare (vedi albumina).
IDRATAZIONE E PERFUSIONE
La valutazione dello stato di idratazione e della perfusione è necessaria per stabilire la quantità e la velocità dei fluidi da infondere.3 Lo stato di idratazione può essere valutato clinicamente oppure misurando la concentrazione del sodio (Gap osmotico = formule 4 e 5). Clinicamente è possibile rivelare alcuni segni che indicano la gravità della disidratazione (Tab. 1).
|
Percentuale di disidratazione |
Segni clinici |
|
5 |
Cute ed altri segni disidratazione nella norma |
|
5 – 6 |
Riduzione elasticità cute, mucose asciutte |
|
6 – 8 |
Ritardo ritorno della plica cutanea, leggero aumento TRC, più i precedenti |
|
10 – 12 |
Cute rimane in plica, polso debole, occhi infossati, compromissione perfusione, più tutti i precedenti |
|
12 – 15 |
Shock ipovolemico scompensato, pericolo vita |
Tabella 1. Disidratazione e segni clinici.
Disidratazioni inferiori al 5% circa non sono rilevabili clinicamente. La percentuale di disidratazione così stimata deve essere moltiplicata per il peso del paziente ottenendo in questo modo la quantità di acqua persa che deve essere reintegrata con la fluidoterapia, come indicato nella seguente formula:
peso kg x % disidratazione = Litri di fluidi da reintegrare (3)
La reintegrazione deve essere rapida, nell’arco di 4-12 ore, se le perdite sono state acute, viceversa se le perdite sono croniche la reintegrazione può essere effettuata nell’arco delle 24 ore. Per quantificare la disidratazione utilizzando l’osmolarità calcolata è necessario quantificare il gap osmolare con il seguente calcolo:
Calcolare l’osmolarità del paziente con la formula:
2(Na++K+) + Bun/2,8 + Glucosio/18 = mOsmol/L (2)
Quindi calcolare il gap anionico come indicato:
Osmol paziente- Osmol normale= Gap osmolare (4)
Osmol gap/ Osmol norm= % di disidratazione (5)
Esempio:
cane di 10 kg con 335 Osmol/L calcolata
- 335 - 310 = 25 mOsmol (gap osmolare)
- 25/310 = 0,081 = 8,1% (percentuale di disidratazione)
- 10 kg = 10.000 ml x 0,081 = 810 ml (volume da reintegrare)
Per stabilire il volume di fluidi da infondere giornalmente ai pazienti oltre alla disidratazione è necessario sommare la quantità di acqua utilizzata per il mantenimento delle funzioni organiche (volume di mantenimento) e l’eventuale acqua persa a seguito del processo morboso in corso (ad es. vomito, diarrea, poliuria). Il volume di mantenimento si calcola con la seguente formula:
30 x kg + 70 = volume di mantenimento (ml) (6)
Volume di mantenimento/24 = velocità di infusione del volume di mantenimento (ml/h) (7)
Il volume calcolato con la formula n. 6 deve essere diviso per 24 per ottenere il volume di millilitri da infondere per ora (vedi formula n. 7). Il volume dei fluidi persi si calcola sommando la quantità persa con ogni episodio, se ad esempio un paziente ha 5 episodi di vomito al giorno e con ognuno di essi espelle 30 ml di materiale, il volume dei fluidi persi da inserire nel computo giornaliero sarà di 150 ml/die.
Il volume totale da infondere giornalmente si calcola con la seguente formula:
Volume di mantenimento + volume di reintegrazione + fluidi persi (8)
Quando il paziente è stato reidratato, ad esempio il giorno successivo a quando è iniziata la fluidoterapia o dopo 4 ore se il volume è stato rimpiazzato più rapidamente, riceverà il solo volume di mantenimento (vedi formula n. 6), solo nel caso in cui ci fossero ancora perdite in corso, al mantenimento si aggiunge il volume dei fluidi persi.
La disidratazione può essere classificata in base alla sua tonicità, è determinato dalla concentrazione del liquido rimasto all’interno dell’organismo e non da quello perso:
- isotonica: quando i valori del Na ematico sono compresi tra i 140 e 150 mEq/L nel cane e 150-160 mEq/L nel gatto;
- ipotonica: se i valori di Na ematico sono <140 mEq/L nel cane e <150 mEq/L nel gatto, può essere riscontrata ad esempio in corso di diarrea, vomito, insufficienza cardiaca congestizia o nella sindrome nefrosica, perdite nel terzo spazio;
- ipertonica: se i valori del sodio ematico sono >150 mEq/L nel cane e >160 mEq/L nel gatto; è rara ed è causata da perdite di acqua pura oppure da perdite di acqua quando nel siero ematico si trova un eccesso di soluti, nel cane può essere causata da perdite di acqua pura, sotto forma di vapor acqueo, in alcuni casi di iperventilazione.
La quantità di sodio presente nel siero è influenzata dalla capacità della cellula di trasportarlo verso il compartimento interstiziale, il trasporto é regolato dall’attività della pompa sodio-potassio, la quale è ATP-dipendente. Tutti i processi morbosi che determinano un ridotta sintesi di energia nei mitocondri (ad es. ipossia), sono associati a un flusso di sodio (e quindi di acqua) verso il compartimento intracellulare, dove può produrre edema e morte cellulare.
La valutazione della perfusione tessutale fornisce informazioni utili al fine di stabilire la velocità di infusione delle soluzioni. Quando la perfusione è compromessa si verifica un minore apporto di sangue ai tessuti e quindi una ridotta ossigenazione, un ridotto apporto di nutrienti e una ridotta rimozione di cataboliti dalle cellule. Un grave deficit della perfusione protratto nel tempo può causare un shock scompensato e morte del paziente.
I parametri utili per valutare la perfusione sono:
- frequenza cardiaca e polso (pericolo se >200 o <60 nel cane,>260 o <150 nel gatto)
- colore delle mucose (bianco: anemia, shock scompensato; blu: cianosi; marrone: metaemoglobinemia; petecchie: coagulopatia; rosso mattone: stato iperdinamico, vasodilatazione periferica)
- tempo di riempimento capillare (TRC, <1 secondo: stato iperdinamico o vasodilatazione periferica, > 2 secondi:perfusione insufficiente);
- pressione arteriosa (sistolica > 100 mmHg, meglio se la media > 80 mmHg);
- produzione di urine (≥1-2 ml/kg/h);
- lattatemia (valori normali 0,5-2,5 mmol/L)
Quando si ha la possibilità di effettuare un monitoraggio più invasivo, per ottenere dei dati oggettivi si possono misurare i seguenti parametri:
- gittata cardiaca;
- disponibilità di ossigeno (DO2)
- consumo di ossigeno (VO2)
- saturazione dell’emoglobina venosa centrale (SVO2)
- resistenze vascolari periferiche
- pressione venosa centrale
- pressione arteriosa invasiva.
I pazienti ipovolemici con parametri della perfusione alterati o non sufficienti ad assicurare un buona perfusione d’organo, devono ricevere una infusione rapida di fluidi in grado di ristabilire un circolo efficace (fluidoterapia rianimatoria). I fluidi comunemente utilizzati per effettuare la fluidoterapia possono essere classificati in base alla loro composizione in cristalloidi e colloidi.
CRISTALLOIDI
I cristalloidi sono soluzioni acquose contenenti molecole di piccole dimensioni osmoticamente attive, hanno una pressione osmotica simile a quella del plasma (circa 300 mOsmol/L) e sono permeabili alla parete vascolare. Sono distinte in bilanciate e non bilanciate, le bilanciate dette anche di reintegrazione, hanno una concentrazione di elettroliti simile a quella dell’ECF, le non bilanciate, dette anche di mantenimento, possono contenere elettroliti e glucosio o solo glucosio. Le bilanciate sono utilizzate per reintegrare i fluidi persi, mentre quelle di mantenimento sono utilizzate per infondere acqua libera, per mantenere l’idratazione nei pazienti che non sono in grado di abbeverarsi oppure per somministrare i farmaci. La scelta del fluido più adatto dipende dallo stato elettrolitico ed acido base del paziente, in quanto i cristalloidi hanno concentrazioni elettrolitiche diverse, pH differente e quantità differente di precursori del sistema tampone (ad es. sodio bicarbonato). I cristalloidi sono utilizzati per rimpiazzare o mantenere idratato il compartimento extravascolare, possono essere utilizzati anche per ripristinare un circolo efficace, effettuando così una fluidoterapia rianimatoria: si somministrano boli di 20 ml/kg/ev ogni15-20 minuti fino ad un massimo di 4 boli nel cane e 3 boli nel gatto. In corso di fluidoterapia rianimatoria è possibile associare i colloidi ai cristalloidi in questo caso è bene ridurre la dose di entrambe secondo la formula:
Cristalloidi 10-30 ml/kg/ev + Colloidi 5-15 ml/kg/ev (9)
Quando i parametri della perfusione (almeno frequenza cardiaca, caratteristiche del polso, TRC, pressione arteriosa e temperatura corporea) rientrano nella norma, la velocità dei cristalloidi è ridotta al mantenimento (vedi formula n. 7) viceversa si ha un elevato rischio di edema tissutale (soprattutto polmonare), emodiluizione, riduzione della concentrazione dell’emoglobina e dei fattori della coagulazione. Dopo e durante la loro somministrazione è bene controllare almeno l’ematocrito e le proteine totali al fine di controllare l’emodiluizione.3,5 I cristalloidi hanno composizioni differenti come indicato nella tabella 2.
|
CRISTALLOIDI |
|||||||||
|
Soluzione |
pH |
Na |
Cl- |
K+ |
Ca++ |
Mg+ |
Osmol/L |
kcal/L |
Buffer mOsmol/L |
|
Sodio Cloruro 0,9% |
5,0 |
154 |
154 |
0 |
0 |
0 |
308 |
0 |
|
|
Ringer lattato (LRS) |
6,5 |
131,5 |
111,5 |
5,5 |
3,5 |
0 |
279 |
0 |
Lattato 29 |
|
Elettrolitica di reintegrazione con sodio gluconato (SER) |
5,5-7,0 |
140 |
98 |
5,0 |
0 |
3 |
Gluconato 23 Acetato 27 |
||
|
Plasmalyte A |
7,4 |
140 |
98 |
5,0 |
0 |
308 |
312 |
0 |
Lattato 8 Acetato 47 |
|
Elettrolitica reidratante III |
5,5 |
140 |
103 |
10 |
5 |
3 |
306 |
0 |
Acetato 47 |
|
Ringer acetato |
6,4 |
132 |
109,5 |
4 |
3 |
0 |
276 |
0 |
Acetato 29,5 |
|
Glucosio 5% |
4,0 |
0 |
0 |
0 |
0 |
0 |
252 |
170 |
0 |
|
Glucosio 2,5% + LRS ½ strenght |
5,0 |
65,5 |
55 |
2 |
1,5 |
0 |
263 |
89 |
Lattato 14 |
|
Glucosio 20% |
4,0 |
0 |
0 |
0 |
0 |
0 |
1112 |
800 |
0 |
|
Glucosio 50% |
4,2 |
0 |
0 |
0 |
0 |
0 |
2780 |
1700 |
0 |
|
NaCl 7% |
5,0 |
1197 |
1197 |
0 |
0 |
0 |
2394 |
0 |
0 |
Tabella 2. Composizione dei cristalloidi più utilizzati.
I cristalloidi ipertonici espandono rapidamente il volume circolante attraendo all’interno del compartimento intravascolare l’acqua dello spazio extravascolare (interstiziale e intracellulare), tale effetto è di breve durata, circa 2-4 ore, la dose necessaria è di 2-4 ml/kg/ev/bolo. Incrementando il volume circolante aumenta anche la gittata cardiaca e la pressione arteriosa, il loro impiego è perciò particolarmente indicato nella fluidoterapia rianimatoria e nel trauma cranico per ridurre l’edema cerebrale. I cristalloidi ipertonici migliorano il flusso ematico nel micorcircolo grazie alla riduzione dimensionale delle cellule endoteliali e della viscosità del sangue. L’effetto di espansione del circolo, in genere si esaurisce nell’arco di circa 4 ore a seguito della ridistribuzione dei fluidi. Per incrementarne l’effetto e la durata sono spesso diluite con colloidi (ad es. destrano 70 ed amidi idrossietilici) formando le cosiddette “Rescue solutions”. Grazie alla possibilità di somministrarne piccoli volumi, le soluzioni saline ipertoniche, sono utilizzate anche nei grossi animali e nella cardiochirurgia per prevenire l’edema derivante dalla fluidoterapia con i cristalloidi isotonici.
Dopo la somministrazione di soluzione salina ipertonica (3 ÷7,5 %) è bene controllare lo stato elettrolitico del paziente per monitorare gli effetti collaterali, anche se in genere transitori, quali: ipernatriemia, ipercloremia e ipokaliemia. Una infusione rapida può causare aritmie ventricolari ed emodiluizione, sono naturalmente controindicate nei pazienti ipernatriemici. Nei pazienti gravemente disidratati, il loro impiego deve essere attentamente valutato ed associato ad una fluidoterapia con cristalloidi isotonici per evitare la disidratazione cellulare e possibili gravi complicazioni. I cristalloidi ipotonici, quali la soluzione di NaCl allo 0,45% e la soluzione glucosata al 2,5%, sono in genere miscelate così da ottenere un’unica soluzione avente un’osmolarità normale ma con un basso contenuto di sodio al fine di ridurre la ritenzione idrica particolarmente controindicata nei pazienti cardiopatici o con insufficienza epatica, tale soluzione è utilizzata anche per trattare l’ipernatriemia.
COLLOIDI
I colloidi sono soluzioni acquose isotoniche che contengono molecole oncoticamente attive grazie alle dimensioni maggiori dei pori capillari. I colloidi attraggono l’acqua all’interno del compartimento vascolare per gradiente osmotico e per elettroneutralità in quanto le molecole dei colloidi, avendo carica negativa richiamano cationi e acqua.4 A seguito dell’espansione del circolo prodotta dopo una loro infusione, i colloidi sono chiamati anche plasmaexpander. L'espansione è rapida e la sua durata dipende dal colloide utilizzato e dalle condizioni della parete vasale. Quando ad esempio in corso di Sirs (Systemic Inflammatory Response Syndrome) i pori della parete vascolare sono aumentati di diametro, l’espansione del circolo e l’incremento della COP è modificata, in questi casi, dato che non è possibile prevederne la durata è bene monitorare strettamente l’effetto emodinamico (almeno pressione arteriosa e parametri della perfusione). L’efficacia del colloide e la sua durata d’effetto dipende dalla capacità di formare legami con le molecole d’acqua e dalla velocità della sua degradazione.6 L’espansione rapida del circolo migliora la perfusione tissutale e la pressione arteriosa media nei pazienti ipotesi e ipoperfusi o in stato di shock ipovolemico e distributivo. Sono quindi indicati in corso di ipoproteinemia, ipoalbuminemia, emorragia, versamento di fluidi nel terzo spazio, trauma, sepsi, ustioni e ipotensione.
La dose di colloidi giornaliera è di 10-20 ml/kg/ev/die, quando invece si infondono in CRI la velocità deve essere di 1-2 ml/kg/ora/ev. L’infusione in CRI è utilizzata quando è necessario incrementare la COP nelle ipoproteinemie. Nel cane, quando è necessario ripristinare un circolo efficace, si possono somministrare 10-20 ml/kg/ev/die in bolo rapido (anche con infusore), nel gatto a seguito della sua particolare sensibilità nei loro confronti, devono essere infusi a boli di 5 ml/kg/ev in 15-20 minuti, se somministrati più rapidamente i pazienti possono manifestare tremori della muscolatura scheletrica e fenomeni eccitativi del SNC. Una eccessiva somministrazione di colloidi può causare emodiluizione (particolare attenzione deve essere posta negli anemici), prolungamento dei tempi di coagulazione, dovuto alla diluizione di fattori della coagulazione, ed edema polmonare. La somministrazione di colloidi non esclude la contemporanea somministrazione dei cristalloidi, in questi casi è però necessario ridurre la dose di entrambe (vedi formula n. 9).
I collidi possono essere distinti in naturali e sintetici, i primi sono: plasma, sangue intero, gelatine, globuli rossi concentrati, emoglobina polimerizzata, albumina umana. I prodotti di origine naturale possono causare reazioni da ipersensibilità e trasmettere malattie infettive. I colloidi di origine sintetica più utilizzati sono gli amidi idrossietilici e i destrani. Nella tabella 2 sono illustrati i colloidi più comunemente utilizzati.
|
COLLOIDI |
|||||||||||
|
Soluzione |
pH |
Na |
Cl- |
K+ |
Ca++ |
Mg+ |
Osmol/L |
Kcal/L |
Buffer mOsmol/L |
COP mmHg |
Durata ore |
|
Tetrastarch 6% |
3,5-6,0 |
154 |
154 |
0 |
0 |
0 |
308 |
0 |
0 |
25 |
4-6 |
|
Hetastarch 6% |
5,5 |
154 |
154 |
0 |
0 |
0 |
310 |
0 |
0 |
32 |
24 |
|
Pentastarch 6% |
3,5-6,0 |
154 |
154 |
0 |
0 |
0 |
308 |
0 |
0 |
25 |
5 |
|
Destrano 40 |
3,5-7,0 |
154 |
154 |
0 |
0 |
0 |
255 |
0 |
0 |
40 |
12 |
|
Destrano 70 |
5,1-5,7 |
154 |
154 |
0 |
0 |
0 |
310 |
0 |
0 |
60 |
24 |
|
Gelatine |
7,2-7,3 |
145 |
145 |
5,1 |
6,26 |
0 |
310 |
0 |
0 |
25 |
2-4 |
|
Succinilgelatine |
7,4 |
154 |
125 |
0,4 |
0,4 |
0 |
279 |
0 |
nd |
n.d. |
2-4 |
|
Albumina umana 5% |
nd |
152 |
nd |
0 |
0 |
0 |
nd |
20 |
20 |
24 |
|
|
Hboc |
7,8 |
150 |
118 |
4 |
1,4 |
0 |
300 |
0 |
Lattato 28 |
37 |
24 |
|
Plasma |
7,4 |
145 |
105 |
5 |
5 |
3 |
300 |
bicarbonato 24 |
17-20 |
24 |
|
Tabella 2. Colloidi (COP= pressione oncotica, HBOC= Hemoglobin Based Oxygen Carriero emoglobina polimerizzata bovina).
Gli amidi idrossietilici sono dei derivati dell’amilopectina la quale è stata idrossilata (aggiunta di gruppi ossidrilici OH) per prolungarne l’emivita in quanto le amilasi sieriche la degradano molto rapidamente. La quantità, la posizione dei gruppi OH sulle molecola di amilopectina ed il peso molecolare delle molecole contenute nella soluzione, influenzano la potenza e la durata d’effetto. Il grado di ramificazione delle molecole di amilopectina idrossilate può essere di 0,4-0,8, i valori ottimali sono di circa 0,4; anche il rapporto di sostituzione C2/C6, condizionato dalla posizione dei gruppi OH influenza la permanenza nel circolo e la durata dell’effetto, il rapporto ottimale è di circa 4-5. Anche il peso molecolare medio (Mw) modifica l’effetto di attrazione dell’acqua e l’emivita della soluzione, il Mw variare da 130.000 D a 450.000 D. L’hetastarch ha un’emivita di circa 24 ore mentre il tertrastarch e il pentastarch è di circa 4-6 ore. La dose massima giornaliera è di circa 20 ml/kg/die. La somministrazione dei colloidi soprattutto a dosi elevate, può provocare aumento dei tempi di protrombina (PT) e tromboplastina parziale (PTT).
I destrani sono soluzioni acquose contenenti polisaccaridi ad alto peso molecolare derivati dalla fermentazione del glucosio e con meno ramificazioni degli amidi idrossietilici. In commercio è possibile trovarne di due tipi: il destrano 40, avente PM 40.000, esercita pressione oncotica pari a 40 mmHg, e il destrano 70, avente PM 70.000, esercita un apressione oncotica di circa 60 mmHg. Sono degradati da numerosi organi alla velocità di 70 mg/kg/24 ore3 , il destrano 70 ha una durata d'effetto di circa 24 ore mentre il 40 di circa 2,5 ore. I destrani sono filtrati liberamente dal glomerulo renale ed entrano nei tubuli dove possono precipitare causando insufficienze renali acute da ostruzione tubulare, tale fenomeno si verifica principalmente nei pazienti disidratati o con pregresse patologie renali. I destrani hanno un’attività reologica positiva riducendo l’adesione tra le superficie cellulari, migliorano il microcircolo in corso di deficit della perfusione e riducono il rischio di trombosi negli stati di ipercoagulazione. La dose giornaliera è di 10-20 ml/kg/ev/die.
Le caratteristiche del plasma sono condizionate dal contenuto proteico, è specie specifico, è separato dal sangue per centrifugazione e commercializzato fresco oppure congelato. Nel primo caso il plasma contiene tutti i fattori della coagulazione, nel secondo caso contieni solo i fattori termostabili. Il prodotto fresco o fresco congelato è utilizzato principalmente quando è necessario ripristinare i fattori della coagulazione nelle coagulopatie da consumo. Può essere utilizzato anche in corso di ipoproteinemia, ma il tal caso sono necessarie grandi quantità di plasma con un aumento dei rischi di ipersensibilità e dei costi. E’ stato utilizzato in corso di Sirs, coagulazione intravasale disseminata (CID) e pancreatite.
L’albumina umana sierica (HSA) è ottenuta da un pool di donatori umani e commercializzata al 5 - 25%. La prima esercita una pressione oncotica simile a quella ematica (20 mmHg), mentre quella al 25% esercita una pressione di circa di 70 mmHg. Può essere diluita in soluzione fisiologica, ringer lattato o soluzione glucosata al 5%. L’albumina è la proteina contenuta in maggior quantità nel sangue, ha un peso molecolare di circa 65.000 D, è responsabile di circa il 70% della COP, svolge così un ruolo fondamentale nella compartimentazione dei fluidi. Un crollo della COP può produrre edema tissutale e morte cellulare. L’albumina oltre a contribuire al mantenimento della COP svolge numerose altre attività: trasporta farmaci, elettroliti, ormoni, lipidi e metalli, rimuove radicali superossidi, molecole infiammatorie, cationi e anioni, aumenta il potenziale redox proteggendo così la parete cellulare dai danni da riperfusione ed inibisce la xantina ossidasi responsabile della morte cellulare nello stadio terminale dello shock. L’albumina si trova anche nello spazio extravascolare, ma in minore concentrazione creando perciò un gradiente osmotico ed un movimento di albumina tra i due compartimenti tale movimento chiamato TER (Transcapillary Escape Rate) è influenzato dalla concentrazione plasmatica dell’albumina, dalla permeabilità della parete microvascolare e dal movimento di soluti ed elettroliti (cariche positive e negative). Quando la TER è alterata da sindromi come la Sirs (ad es. ipoalbuminemia nella gastroenterite da parvovirus) è possibile somministrare l’HSA al 5% in CRI a 2 ml/kg/ora ad una dose totale di 20 ml/kg/die per ripristinare la COP e la perfusione. Tale velocità e quantità impone un’infusione di circa 10 ore, durante la quali è possibile avere un miglioramento del TER e dei parametri della perfusione, inoltre a tale velocità l’autore non ha mai riscontrato fenomeni idi ipersensibilità incompatibili con la vita nel cane e nel gatto anche quando sono l’albumina al 5% è stata infusa nello stesso paziente per più giorni.2L’effetto collaterale più frequente è l’emodiluizione, durante l’infusione è bene comunque monitorare il paziente per rilevare il più precocemente possibile la comparsa di reazioni allergiche quali: tremori, orticaria, anafilassi, scialorrea, ipertermia e diarrea. La dose massima di somministrazione giornaliera della HSA al 5% è 20 ml/kg/die/ev, per ridurre i rischi da ipersensibilità è bene somministrarla ad una velocità massima di 2 ml/kg/ora/ev.
Le soluzioni contenenti gelatine prodotte con idrolisi a caldo del collagene osseo di origine bovina possono avere struttura reticolare con ponti di urea, succinilgelatine oppure gelatine fluide modificate. Il loro peso molecolare è di circa 3000 D, l’effetto di espansione del circolo è di circa 2 ore. Può causare reazioni allergiche da ipersensibilità con maggior frequenza rispetto al destrano. La dose per ottenere l’espansione del circolo è di 20 ml/kg/die/ev.
L’emoglobina polimerizzata di origine bovina (HBOC = Hemoglobin Based Oxygen Carrier) ha due caratteristiche fondamentali: è più piccola dell’emoglobina normale, diffonde perciò meglio nei tessuti mal perfusi o parzialmente ostruiti, ed ha una minore affinità con l'ossigeno, rendendolo più disponibile ai tessuti. Ha una osmolarità di circa 300 mosmol/L, un Mw di 65.000-130.000 D e un pH di 7,8. Svolge azione di plasma expander e di trasporto dell’ossigeno. L’HBOC ha una COP di circa 20-25 mmHg, l’effetto dura circa 24 ore. A seguito della sua somministrazione il siero assume un colorito rossastro che ostacola la lettura di esami biochimici e la determinazione dell’ematocrito. L’ematocrito misurato successivamente alla sua somministrazione non ne rispecchia il suo incremento in quanto le molecole di emoglobina contenute nell’HBOC non sono determinabili con un esame emocromocitometrico e con il rifrattometro. La somministrazione di 15-30 ml/kg incrementano rispettivamente l’emoglobina di 2,5-4 g/L. L’ HBOC è stabile a temperatura ambiente per circa 3 anni e può essere somministrato senza effettuare test di sensibilità crociata sia nel cane che nel gatto (anche negli animali esotici). Quando la confezione è stata aperta è necessario somministrarla entro 24 ore. E’ raccomandata in corso di anemia, emorragie, shock ipovolemico e ischemia. Dopo la sua somministrazione può comparire ittero e emoglobimuria. Il dosaggio è di 10-30 ml/kg/h/ev per somministrazione (in caso di gravi emorragie può essere somministrata anche più volte fino a 40 ml/kg/die). Non è disponibile in Italia.
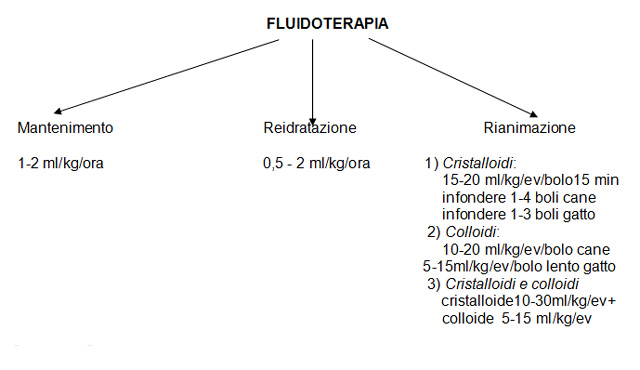
Nello schema sottostante sono riassunte le modalità di soministrazione dei fluidi.
Bibliografia
- Wellman ML, DiBartola SP, KohnCW. Applied physiology of body fluids in dogs and cats. In Di Bartola SP ed. Fluid electrolyte and acid-base disorders in small animal practice. St. Louis: Saunders, Elsevier; 2006, pp.3-25
- Vigano’F, Perissinotto L, Bosco V. Administration of 5% human serum albumin in dogs and cats. J Vet Emerg Crit Care 2010; 20(2):237-243
- Tonozzi C, Rudloff E., Kirby R.Perfusion versus Hydration: impact on the fluid therapy plan. Compend Contin Educ Vet 2009;31(12):E1-E14
- Chan DL, Rozanski EA, Freeman LM, Rush JE, Colloid osmotic pressure in health and disease. Compend Contin Educ Pract Vet. 2001; 23(10):896-904.
- Viganò F. Fluidoterapia. In F. Vigano’ Ed. Medicina d’urgenza e terapia intensiva del cane e del gatto, Milano/Cremona Masson/E.V. S.r.l.; 2005, pp. 50-62.
- Chan DL. Colloids: current recommendations. Vet Clin North Am Small Anim Pract 2008 May;38(3):587-93,xi.