Tumori del cavo orale
- Disciplina: Oncologia
- Specie: Cane e Gatto
I tumori del cavo orale rappresentano rispettivamente il 6% e il 3% di tutte le neoplasie canine e feline.1,2 La tipologia neoplastica è molto ampia e ogni settore della bocca ne può risultarne colpita. Nel cane dai tessuti molli derivano, in ordine di frequenza: melanoma maligno (MM), carcinoma squamoso (CS) e fibrosarcoma (FSA); si segnalano inoltre epulidi e papillomatosi orale. I tumori derivanti dai tessuti duri possono essere suddivisi in: derivanti dall’osso (osteosarcoma e, più raramente, altri sarcomi) e dai tessuti dentali (tumori c.d. odontogenici quali ameloblastoma, fibro-odontoma ameloblastico, odontoma, fibroameloblastoma e cisti dentigere). Si segnalano infine i tumori di più raro rilievo clinico. I maschi, specie in caso di CS tonsillare, MM e FSA, sono più colpiti delle femmine.1 I tumori benigni in grado di infiltrare l’osso sono l’epulide acantomatosa e l’ameloblastoma; le forme maligne infiltrano tutte l’osso più o meno precocemente. Nel gatto le neoplasie maligne includono CS e sarcomi e tutte infiltrano l’osso. I tumori benigni, comprese le epulidi, sono rari.
CLASSIFICAZIONE
EPULIDI
Originano dal legamento periodontale, sono benigne e classificate come: 1) fibromatosa (Fig. 1), 2) ossificante (Fig. 2), 3) acantomatosa (EA) (Figg. 3a e 3b) e 4) a cellule giganti.1 Per quanto benigne, tutte le epulidi possono recidivare se non opportunamente trattate; comunque, solo l’EA e occasionalmente le epulidi ossificanti a larga base di impianto richiedono l’asportazione anche dell’osso sottostante (escissione “en bloc”) (Figg. 4a, 4b, 4c, 4d). Nell’EA, che predilige la parte rostrale della due arcate dentarie (Fig. 3A e 5), l’osso appare radiograficamente coinvolto. In alternativa alla chirurgia può essere proposta la radioterapia (tasso di controllo in almeno il 90% dei casi) ma, fino al 10% delle AE e soprattutto se si è fatto uso di apparecchi ad ortovoltaggio (oggi solo raramente ancora utilizzati), oltre alla necrosi ossea radioindotta, è possibile in un tempo variabile lo sviluppo nella parte irradiata di sarcomi o, più raramente, di carcinomi.5,6 Si segnala infine la possibilità di trattamento mediante iniezione locale di bleomicina.52


I boxer, ma anche altri brachicefali e, occasionalmente, anche soggetti di altre razze, possono sviluppare epulidi multiple interpretabili anche come iperplasia gengivale diffusa (Fig. 6). In tali casi è ipotizzabile una predisposizione famigliare. Le lesioni sono citoridotte chirurgicamente solo nel caso in cui queste interferiscano con l’assunzione del cibo e la masticazione. Nel gatto, nel quale non è riportata l’EA, le epulidi sono estremamente rare e spesso sono multiple (Fig. 7a, 7b) e, nel 50% dei casi, si rilevano in soggetti di meno di 3 anni.1


MELANOMA MALIGNO (MM)
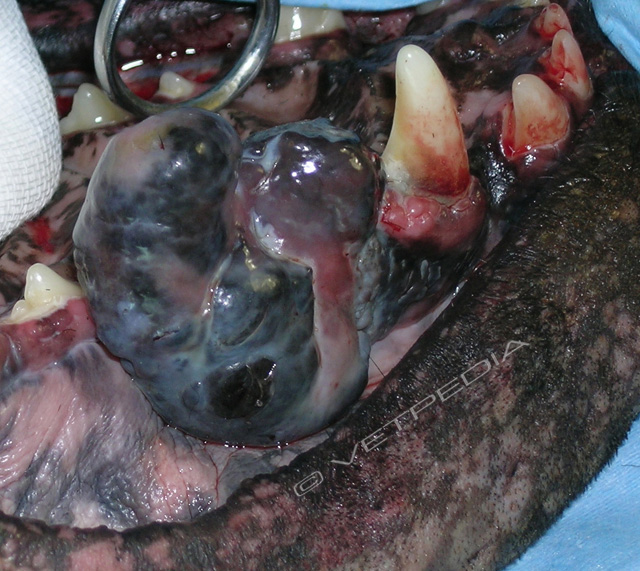
Rappresenta il 30-40% dei tumori maligni del cavo orale del cane.1,2 Ne sono soprattutto predisposti soggetti di piccola taglia ma anche Chow chow e altri cani di taglia grande (ma in misura minore) a intensa pigmentazione mucosa e di oltre 10-11 anni di età.1,7,8 Sembra prevalere nei maschi. Può originare in ogni punto della cavità orale, comprese le tonsille (Fig. 8); quello gengivale è più frequente a livello dei premolari inferiori (Figg. 9a, 9b, 9c) o dei molari superiori (Fig. 10).
È spesso ulcerato, facilmente sanguinante e necrotico (alitosi); alcuni si presentano in forma peduncolata o con base di impianto limitata, specie a livello di guancia o giunzione mucocutanea (Fig. 11a, 11b). Il grado di pigmentazione (melanotico, parzialmente melanotico o amelanotico - Figg. 11 e 12a, 12b) non rappresenta un parametro prognostico.
Le forme amelanotiche, comunque, sono più difficili da riconoscere istologicamente ed è spesso emessa diagnosi di tumore indifferenziato o anaplastico o, addirittura, di tumore epiteliale.1 L’immunoistochimica (Melan A) può essere di aiuto ma nelle forme indifferenziate il problema permane.8 Il tasso di crescita della neoplasia è elevato, con precoce invasione ossea locale (aumento di mobilità e perdita di denti); alto è anche il tasso metastatico (linfonodi regionali omolaterali fino al 70-80% dei casi, già in presentazione, anche bilateralmente in caso di localizzazione aborale; infine, a polmoni e altri organi) (Figg. 13a, 13b, 14a, 14b, 14c, 15).1 La metastatizzazione appare soprattutto condizionata da sede, dimensioni e stadio clinico.1,9,10
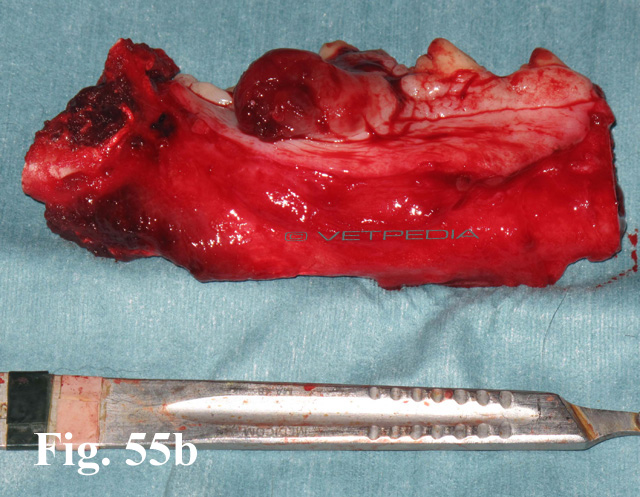
I fattori prognostici da considerare sono: dimensioni (oltre 2 cm o 8cm3), localizzazione (prognosi lievemente più favorevole per i MM rostrali dell’arcata inferiore o aborali di quella superiore) e indice mitotico (< o > 3 mitosi a forte ingrandimento). I MM peduncolati, al pari di quelli a sviluppo linguale (terzo aborale – Fig. 16a, 16b o sul labbro (Figg. 11), sembrano caratterizzati da indice metastatico più ridotto.1 L’unica opzione realmente curativa consiste, quando possibile, nell’escissione “en bloc”, da eseguirsi in casi selezionati (dimensioni ridotte e linfonodi regionali negativi o metastatici solo alla prima stazione). L’associazione con i trattamenti adiuvanti classici (radioterapia, chemioterapia – per lo più cisplatino o carboplatino), anche se migliora il controllo locale della neoplasia fino ad un 75% dei casi, consente una sopravvivenza ad 1 anno in non oltre il 30% dei casi.1,11-23 Risultati promettenti sono stati recentemente raggiunti con l'immunoterapia. Nel gatto il MM orale è rarissimo ma il suo comportamento biologico-clinico è simile a quello rilevato nel cane.

 *Un vaccino (genetico a DNA) di recente ideazione, in particolare, è sembrato in grado di prolungare la sopravvivenza dei soggetti colpiti, specie se il trattamento è associato ad altre procedure quali chirurgia o radioterapia finalizzate a ridurre la malattia a livello microscopico.2 *Un vaccino (genetico a DNA) di recente ideazione, in particolare, è sembrato in grado di prolungare la sopravvivenza dei soggetti colpiti, specie se il trattamento è associato ad altre procedure quali chirurgia o radioterapia finalizzate a ridurre la malattia a livello microscopico.2 |
CARCINOMA SQUAMOSO (CS)
Cane. E’ il secondo tumore maligno più frequente. Si sviluppa più spesso in soggetti di taglia medio-grande, in media di 8-10 anni, ma è possibile rilevarlo anche in soggetti più giovani, senza predisposizione di sesso o razza. Può originare in ogni parte della cavità orale, comprese le tonsille. Per quello gengivale non pare sussista alcuna correlazione fra patologie parodontali e sviluppo tumorale; quello tonsillare è invece più frequente nei soggetti che vivono in aree urbane.1 È friabile e di aspetto nodulare, a cavolfiore o a placca e presenta frequentemente aree necrotiche e ulcerate (Figg. 17a, 17b).
Infiltrazione ossea è rilevabile in circa il 75% dei casi; ne consegue un aumento di mobilità sino alla caduta di uno o più denti (Fig. 18a, 18b, 18c, 18d) .
Se lo sviluppo è a livello della parte rostrale del cavo orale (Fig. 18a) è caratterizzato da comportamento meno aggressivo (metastasi ai linfonodi regionali nel 5-10% dei casi, 3% ai polmoni): questo implica che la resezione “en bloc” può esitare in un alto tasso di sopravvivenza a 1 anno (fino al 90% secondo alcuni studi).1 Al contrario, le localizzazioni più aborali sono contraddistinte da prognosi meno favorevole con possibilità di metastatizzazione più precoce (fino all’90% dei casi in prima presentazione per le localizzazioni linguali (Figg. 19a, 19b, 19c, 64a, 64b) e tonsillari (Figg. 20a, 20b, 20c, 20d, 20e).1,8 Le altre localizzazioni sono caratterizzate da prognosi “intermedia” dipendente da localizzazione, dimensioni, grado di invasione e metastatizzazione regionale.
La radioterapia, essendo il CS particolarmente radiosensibile, può essere proposta nei casi inoperabili a scopo palliativo. Il successo della chemioterapia è controverso visto che il tasso metastatico è in genere non elevato; alcuni studi indicano comunque la sua possibile utilità in CS non tonsillari, anche in associazione a farmaci anti-Cox2 come il proxicam.22,28 Questa associazione è comunque molto nefrotossica.
Gatto. Il CS è il tumore orale più comune in questa specie (70%) dove sembra sussistere un rischio correlato all’uso di collari antipulci, fumo di sigaretta ed alimentazione a base di scatolette (in particolare a base di pesce).29 I gatti colpiti sono in genere di oltre 10 anni di età. Può originare in qualsiasi punto del cavo orale ma la localizzazione tonsillare è rara. Il suo comportamento è simile al CS canino ma l’invasione locale, spesso in forma di ampie e profonde ulcerazioni, è molto più intensa (tumore e infezione secondaria) (Figg. 21a, 21b) come rilevato radiograficamente nella maggior parte dei casi già in prima valutazione, specie a livello mandibolare dove si assiste spesso ad un’intensa reazione periostale (fino a simulare un sarcoma osseo – Figg. 22a, 22b, 22c). La vasta distruzione tissutale pregiudica quasi sempre la possibilità di escissione chirurgica. L’ulcerazione può essere assente nel CS “intralveolare”, molto raro e che origina forse dalla lamina dentale. In letteratura è segnalata la possibilità di ipercalcemia paraneoplastica.30
Se la chirurgia non è un’opzione realistica (e ciò accade spesso), può essere preso in considerazione il controllo locale del tumore mediante radioterapia. Questo non è però possibile in caso di localizzazione del CS a livello della base della lingua (Figg. 23A e B), e oggi purtroppo, in questo caso, non è proponibile alcun trattamento realmente efficace; in casi eccezionali (localizzazione favorevole) è comunque possibile la resezione chirurgica.
FIBROSARCOMA
Rappresenta il 10-20% di tutte le neoplasie orali maligne del cane (dopo MM e SCC) ed è secondo in frequenza nel gatto.1 L’età media dei cani colpiti è di 7 anni ma un 25% circa dei soggetti ha meno di 5 anni. Prevale nei cani maschi dolicocefali di taglia grande. Può svilupparsi a livello di gengive, palato duro, lingua e mucosa labiale. La forma gengivale è più spesso localizzata a livello dell’arcata superiore, fra canino e quarto premolare (Figg. 24a, 24b, 24c); in quella inferiore è generalmente più rostrale (Figg. 25a, 25b, 25c). Appare come lesione lardacea solida rosata, a crescita lenta e compatta e solo occasionalmente ulcerata. Talvolta, in stadio iniziale, può apparire in forma peduncolata. Il tasso di infiltrazione locale è elevato ma a livello osseo questa è apprezzabile solo in fase avanzata (Fig. 26); istologicamente, può apparire a bassa o ad alta malignità (c.d. “low” o “high” grade FSA); quelli a bassa malignità istologica (talvolta diagnosticati come “fibroma”) sono comunque considerati ad alta malignità dal punto di vista biologico (Fig. 27).31 Il tasso metastatico, anche ai linfonodi regionali, è basso (massimo 25-30% dei casi).11,13,32,33
Questo implica che la chirurgia deve essere operata mediante escissioni spesso di tipo “compartimentale”, assicurando in tal modo un più ampio margine di tessuto sano tutto intorno alla neoplasia. La recidiva è frequente (fino al 60% dei casi) con sopravvivenza ad 1 anno, nel cane, del 40-50%.1 Il controllo locale della neoplasia richiede spesso l’irradiazione “adiuvante”, con sopravvivenza mediana di 18-26 mesi e tasso di sopravvivenza a 1 anno del 76%.1
Nel gatto la biologia clinica e le localizzazioni del fibrosarcoma sono simili al cane (Figg. 28a, 28b); anche in questo caso solo in taluni casi è possibile considerare la chirurgia come un’opzione realistica.
OSTEOSARCOMA
Cranio e mandibola ne sono colpiti nel 10-15% dei casi, in forma sia erosiva sia produttiva (Figg. 29a, 29b). Si sviluppa di preferenza in cani di media-grossa taglia di età media o avanzata, a livello aborale, sia nell’arcata superiore sia inferiore (Fig. 30), con lieve prevalenza (forse) delle femmine. Nel confronto con il fenotipo appendicolare, l’OSA orale, se rimovibile “en bloc”, è caratterizzato da miglior prognosi, con minor tendenza alla disseminazione metastatica (sopravvivenza ad 1 anno nel 35-70% circa dei casi).1,11,13,34 Per tale ragione, la chemioterapia adiuvante non è adottata. L’elemento critico è dunque la sua escissione aggressiva a margini puliti (emimandibolectomia completa se a livello dell’arcata inferiore); la radioterapia e/o la chemioterapia adiuvanti non migliorano la prognosi.
Nel gatto è raro e se rimovibile “en bloc” a margini puliti (ma purtroppo questo non è frequente) è caratterizzato da prognosi favorevole considerato il suo limitato tasso metastatico, analogamente al fenotipo appendicolare.
PAPILLOMATOSI VIRALE DEL CANE
Escrescenza a cavolfiore singola o multipla esito di infezione da un DNA Papovavirus specie-specifico trasmesso orizzontalmente. Occasionalmente può evolvere a CS. I cani colpiti sono in genere di meno di 1 anno di età ma, occasionalmente, ne possono risultare affetti anche soggetti più anziani (eventualmente immunodepressi per ragioni diverse – Fig. 31). Le lesioni sono tipicamente localizzate a cavo orale (Figg. 31a, 31b), labbra o palpebre. In genere regrediscono spontaneamente in 1-3 mesi in esito alla risposta immunitaria evocata.1 In passato si è ricorsi ad autovaccini ma è segnalata la possibilità di sviluppo di tumori cutanei maligni nella sede di loro inoculazione.4 In letteratura è infine riportata la possibilità di sviluppo di placche pigmentate (nel miniature schnauzer, Pomerania e American Staffordshire terrier) che possono evolvere in taluni casi a CS.35
TUMORI ODONTOGENI
Di derivazione dall’epitelio della lamina dentale, sono tutti benigni e possono contenere differenti componenti dentali. Il più importante del gruppo è l’ameloblastoma (in passato confuso con l’AE).36 Tipicamente si sviluppa in cani di media età, con lieve prevalenza dei maschi di taglia medio-grande; è localmente invasivo (con esito in aumento di mobilità e perdita localizzata di denti), non metastatizza e può apparire uni- o multi-cistico all’esame radiografico e tomografico (Figg. 33a, 33b, 34a, 34b). Clinicamente si presenta come massa irregolare solida ricoperta da epitelio o come forma più invasiva e ulcerata, con aree di necrosi (Fig. 35). L’opzione terapeutica di scelta è l’escissione “en bloc”, comprendendo nella rimozione anche l’osso sottostante. La prognosi è favorevole dopo escissione a margini puliti. Tra i trattamenti eseguibili si segnala anche la possibilità di iniezione locale di bleomicina e interleuchina 12 con elettroporazione.53,54
Più rari sono: odontoma, fibro-odontoma ameloblastico, fibroameloblastoma induttivo*, tumore odontogenico epiteliale calcificante del gatto e cisti dentigere** (Figg. 36a, 36b); queste lesioni sono tutte caratterizzate da andamento clinico benigno, senza tendenza alla metastatizzazione, per cui l’asportazione chirurgica, con eventuale “grafting” con osso spongioso autologo, risulta di solito curativa.1 La radioterapia trova indicazione, in tutti i casi, per le lesioni più voluminose.
|
*Fibroameloblastoma induttivo: è tipico del gatto giovane con predilezione per la regione dei canini superiori. **Cisti dentigere: sono lesioni circoscritte che originano da isole di epitelio odontogenico.1 Contengono uno o più denti non erotti e possono rappresentare una fase precancerosa. |
TUMORI DI PIÙ RARO RILIEVO
Si segnalano: mioblastoma a cellule granulari*, tumori giovanili (sarcomi - Fig. 37 - o neoplasie indifferenziate, CS papillare, etc)1, osteocondrosarcoma multilobulare** (Figg. 38a, 38b, 38c),38,39 altri tumori mesenchimali, tumori a cellule rotonde (mastocitoma, linfoma, etc) (Figg. 39a, 39b, 39c, 39d), tumori delle ghiandole salivari minori (eccezionali), etc.
SEGNI CLINICI
I soggetti colpiti sono spesso condotti a visita quando la neoplasia è già ad un avanzato stadio di sviluppo in quanto, in fase iniziale, sono spesso asintomatici e non visibili, specie se aborali. L’alitosi (da necrosi ed ulcerazione ed infezione locali) è intensa specie nel MM, meno nel CS; il sanguinamento, franco o misto a saliva (scialorrea), è rilevabile sia in caso di MM sia di CS e di altri tumori ulcerati; in taluni tumori mascellari, si osserva anche epifora per coinvolgimento del condotto naso lacrimale. Talvolta il rilievo clinico della lesione è casuale, in occasione ad esempio di una procedura di pulizia dentale; in altri casi per caduta spontanea di uno o più denti. Quest’ultima evenienza deve essere considerata con sospetto (specie in caso di assenza di evidente paradontopatia in altre sedi) ed obbligare al prelievo bioptico sin da subito. In fase più avanzata la gravità dei segni clinici in presentazione dipende dalla localizzazione: ad esempio, difficoltà di apertura della bocca, dolore e gradi diversi di esoftalmo e/o di deviazione del bulbo oculare sono caratteristici di invasione dello spazio retro-bulbare. Possono inoltre risultare evidenti deformazioni facciali di grado diverso. Disfagia o rinorragia e/o rumori respiratori (faringei o nasali) sono talvolta segnalati in caso di localizzazione aborale della neoplasia o per invasione endonasale (parametro prognostico negativo ai fini del solo trattamento chirurgico – Figg. 18a, 18b, 18c, 18c, 20a, 20b, 20c, 20d, 20e, 26); a volte invece i proprietari segnalano difficoltà nella prensione degli alimenti (tumori linguali o lesioni di grande dimensioni). Può infine rendersi evidente una linfoadenopatia regionale omolaterale o, in caso di lesioni aborali, anche bilaterale. I linfonodi possono risultare lisci e mobili (compatibilmente con un quadro di reattività) oppure già con i caratteri evidenti di colonizzazione tumorale (superficie irregolare, dura e fissità di vario grado). La linfadenopatia cervicale può rappresentare il primo segno clinico evidente di CS tonsillare.
DIAGNOSI
La valutazione del paziente prevede:
- Anamnesi (soprattutto relativa all’eventuale perdita spontanea o a seguito di estrazione troppo “agevole” di singoli denti)
- Esame clinico accurato. L’ispezione del cavo orale (da eseguirsi in anestesia) rivela in genere la lesione. Un’importante raccomandazione è di non emettere alcuna diagnosi (tutt’al più solo un sospetto) sulla base del solo esame ispettivo in quanto sono molte, sia nel cane sia nel gatto, le lesioni che possono simulare una neoplasia orale maligna: granuloma eosinofilico (gatto – Figg. 40a, 40b, 40c - e, più raramente cane* (Fig. 41 )
 ,40-42 gengivite/stomatite/glossite a diversa eziologia (infettiva specifica o aspecifica), stomatite linfoplasmacellulare (gatto, Fig. 42), malattie parodontali e dentali, osteomieliti da cause diverse (Fig. 43), leishmaniosi mucosale (cane), calcinosis circumscripta orale (in genere a livello della lingua, a diversa localizzazione – Fig. 44), malattie autoimmuni, malattie diverse delle ghiandole salivari, malattie retrobulbari (Fig. 45), malattie dell’osso (osteopatia craniomandibolare del cane – Fig. 46, osteodistrofie, etc), polipi infiammatori rinofaringei del gatto, ascessi (Figg. 47a, 47b) etc. Si segnala infine che neoplasie molto diverse tra loro (ad es. osteosarcoma, epulide ossificante ed ameloblastoma) possono in taluni casi presentarsi clinicamente in modo simile.
,40-42 gengivite/stomatite/glossite a diversa eziologia (infettiva specifica o aspecifica), stomatite linfoplasmacellulare (gatto, Fig. 42), malattie parodontali e dentali, osteomieliti da cause diverse (Fig. 43), leishmaniosi mucosale (cane), calcinosis circumscripta orale (in genere a livello della lingua, a diversa localizzazione – Fig. 44), malattie autoimmuni, malattie diverse delle ghiandole salivari, malattie retrobulbari (Fig. 45), malattie dell’osso (osteopatia craniomandibolare del cane – Fig. 46, osteodistrofie, etc), polipi infiammatori rinofaringei del gatto, ascessi (Figg. 47a, 47b) etc. Si segnala infine che neoplasie molto diverse tra loro (ad es. osteosarcoma, epulide ossificante ed ameloblastoma) possono in taluni casi presentarsi clinicamente in modo simile.










|
|
- Esami ematologici, ematochimici e dell’urina. Nel gatto è sempre opportuno valutare anche lo stato FIV e FeLV.
- Biopsia incisionale della lesione orale. Si può eseguire in semplice sedazione se il soggetto è collaborativo e in caso di lesioni esofitiche già ulcerate, oppure (preferibile) in narcosi. Il prelievo può essere eseguito al centro od anche ai limiti della lesione (senza però modificare la pianificazione del successivo trattamento); deve inoltre essere sufficientemente profondo (la parte superficiale è infatti spesso infetta, necrotica ed ulcerata). Il campione così prelevato può essere immediatamente sottoposto ad esame citologico (per impronta o scarificazione) e poi avviato alla valutazione istologica. La biopsia ad ago sottile delle lesioni orali non è di norma eseguita a motivo dell’imponente contaminazione ematica e della infiammazione/infezione/necrosi che complicano spesso l’interpretazione citologica del campione; va inoltre sottolineato che alcuni tumori esfoliano solo minimamente (FSA, sarcomi in genere, epulidi, etc). Per alcune lesioni (ad esempio epulidi fibromatose, papillomi, etc) la biopsia escissionale può già corrispondere al trattamento definitivo.
- Biopsia ad ago sottile dei linfonodi regionali/satelliti (mandibolari, parotidei, retrofaringei mediali)1, specie se ingranditi. Non necessariamente, comunque, all’ingrandimento linfonodale corrisponde un coinvolgimento metastatico; allo stesso modo, la negatività citologica non esclude il loro coinvolgimento metastatico e, ai fini soprattutto della stadiazione tumorale, il/i linfonodo/i va/vanno rimossi contestualmente all’escissione del tumore primario.
- Esame radiografico del torace (in proiezione latero-laterale destra e sinistra e DV, in inspirazione): eseguito per escludere la possibile disseminazione metastatica polmonare (più probabile in caso di MM)
- Esame radiografico dell’area sede della lesione primaria nelle opportune proiezioni (DV, laterale, obliqua, a “bocca aperta”, intraorale, etc) al fine di valutare l’eventuale interessamento osseo in forma litica od osteoproduttiva. Il coinvolgimento osseo è evidente radiograficamente quando l’erosione interessa almeno il 40% della corticale.1 Questo implica che, se la diagnosi istologica è di tumore maligno, l’escissione chirurgica deve comunque comprendere anche l’osso sottostante, anche in assenza di erosione già evidente.
- Nella maggior parte dei casi, al fine di pianificare in modo più corretto l’intervento chirurgico, è opportuno ricorrere a TAC o RMN. Queste ultime sono molto più sensibili nel definire l’eventuale invasione retrobulbare, endonasale, etc rispetto all’esame radiografico. La valutazione è a quel punto estesa al collo (linfoadenopatie - Fig. 48) e al torace (metastasi polmonari), specie in caso di tumori biologicamente aggressivi.

- Esame ecografico dell’addome. Solo in casi selezionati e per neoplasie particolarmente maligne.
- Esame cardiologico fino alla ecocardiografia (soggetti anziani, specie se di grossa taglia).
TRATTAMENTO
I principali fattori prognostici pre-trattamento da considerare sono:
- Tipo istogico: a questo corrisponde uno specifico comportamento biologico-clinico che va tenuto presente nella pianificazione del trattamento complessivo. Relativamnte alla chirurgia, questo parametro condiziona l’entità della resezione necessaria
- Localizzazione tumorale: condiziona il grado di accessibilità chirurgica. In generale i tumori rostrali sono più aggredibili rispetto a quelli aborali; allo stesso modo sono di più difficile approccio le lesioni che si estendono oltre il piano sagittale mediano (per problemi di ricostruzione)
- Stadio clinico TNM (OMS)9. La classificazione TNM considera: 1) dimensioni (parametro T, che influenza sia l’aggredibilità chirurgica - che dipende, tra l’altro, anche dalla taglia dell’animale – sia la tendenza a disseminare – ad es. in caso di MM); 2) stato dei linfonodi regionali (parametro N, anche se negativi citologicamente, in caso di neoplasia maligna quelli relativi alla prima stazione vanno escissi contestualmente alla lesione primaria e valutati istologicamente; se la lesione tumorale è aborale è preferibile rimuovere i linfonodi regionali di entrambi i lati; in generale, in caso di positività della prima stazione linatica, questi soggetti sono ancora considerati pazienti “chirurgici”); 3) presenza di metastasi lontane (parametro M, metastasi a seconde e successive stazioni linfatiche o ad organi lontani; se presenti, il trattamento può essere solo di tipo palliativo)
- Condizioni fisiche generali del paziente. Questo è un parametro ovvio visto che solo pazienti clinicamente “sani”, indipendemente dall’età, dovrebero essere considerati come candidati al trattamento.
Le procedure terapeutiche più spesso utilizzate sono la chirurgia e la radioterapia. La criochirurgia è storicamente indicata per i CS di meno di 1-2 cm ma oggi è molto raramente adottata.
La chirurgia “en bloc” è consigliabile per tutte le neoplasie maligne che risultino asportabili; rappresenta inoltre una valida opzione, tra l’altro meno costosa dell’irradiazione, per le lesioni benigne di grandi dimensioni. In caso di neoplasia maligna, indipendentemente dall’evidenza o meno di coinvolgimento osseo, quest’ultimo piano è da comprendere sempre nell’escissione “en bloc” (Altri trattamenti). Se la chirurgia rischia di determinare un’inaccetabile perdità di funzionalità, le alternative possono essere radioterapia (più spesso) e/o chemioterapia (più raramente), in forma palliativa (Figg. 49a, 49b, 49c) o adiuvante.
La radioterapia adiuvante è in tale strategia utilizzata dopo escissione meno aggressiva, dove maggiore è la probabilità di margini “non puliti”  (Figg. 50a, 50b, 50c), ; la chemioterapia adiuvante è invece indicata per limitare la disseminazione metastatica. La radioterapia è impiegabile con successo per tumori radiosensibili come EA, CS e, anche se in misura minore, ameloblastoma; inoltre come adiuvante in caso di FSA e CS e come palliazione in caso di CS, FSA e MM inoperabili. L’irradiazione può anche essere coadiuvata dall’uso di radiosensibilizzanti (cisplatino, carboplatino, gemcitabina, etc); in caso di MM l’impiego di elevate dosi x frazione erogate in poche sedute può migliorare il controllo locale della neoplasia.
(Figg. 50a, 50b, 50c), ; la chemioterapia adiuvante è invece indicata per limitare la disseminazione metastatica. La radioterapia è impiegabile con successo per tumori radiosensibili come EA, CS e, anche se in misura minore, ameloblastoma; inoltre come adiuvante in caso di FSA e CS e come palliazione in caso di CS, FSA e MM inoperabili. L’irradiazione può anche essere coadiuvata dall’uso di radiosensibilizzanti (cisplatino, carboplatino, gemcitabina, etc); in caso di MM l’impiego di elevate dosi x frazione erogate in poche sedute può migliorare il controllo locale della neoplasia.
La chemioterapia classica, così come anche l’uso di anti-Cox2 (da soli o in associazione a sali di platino, sia per CS e MM) non ha fino ad ora trovato un ruolo preciso.15,18,22,23,28 In caso di MM è inoltre possibile la vaccinazione.24-27
CHIRURGIA
Gli interventi eseguibili sono la mandibolectomia e la maxillectomia; inoltre chirurgie diverse a carico dei soli tessuti molli (tonsille, lingua, labbra, guancia, etc). Lo strumentario chirurgico essenziale prevede, oltre al normale corredo per tessuti molli, martello e scalpelli, pinze ossivore e sega oscillante. In caso di tumore maligno, i margini di escissione dovrebbero essere di almeno 2 cm; questo è difficilmente proponibile nel gatto (lesione troppo avanzata). Qualora si abbia il dubbio o si possa anticipare un problema di prensione dell’alimento e/o di complicanze di vario genere nell’immediato post-operatorio è bene concludere l’intervento con l’applicazione di un sondino esofageo (Figg. 51a, 51b) al fine di gestirle più agevolmente e consentire all’animale di imparare ad alimentarsi per os adattandosi alla nuova situazione.
Nei riguardi dei tumori dell’arcata inferiore gli intergenti eseguibili sono: 1,11,30,33,43-47
 Nei riguardi dei tumori dell’arcata superiore gli interventi eseguibili prevedono la rimozione di parti variabili di osso mascellare, incisivo e/o palatino, nasale, lacrimale ed arco zigomatico. La parte ossea rimanente deve essere sufficiente a garantire stabilità della parte e pervietà delle vie respiratorie, senza necessità di innesti protesici. In caso di resezioni mascellari molto estese, può essere indicato nel cane ricorrere, per limitare il sanguinamento intraoperatorio (specie nei oggetti di grossa taglia), alla legatura temporanea delle due arterie carotidi comuni (a livello del collo, approccio sagittale ventrale) (Figg. 58a, 58b).48,49
Nei riguardi dei tumori dell’arcata superiore gli interventi eseguibili prevedono la rimozione di parti variabili di osso mascellare, incisivo e/o palatino, nasale, lacrimale ed arco zigomatico. La parte ossea rimanente deve essere sufficiente a garantire stabilità della parte e pervietà delle vie respiratorie, senza necessità di innesti protesici. In caso di resezioni mascellari molto estese, può essere indicato nel cane ricorrere, per limitare il sanguinamento intraoperatorio (specie nei oggetti di grossa taglia), alla legatura temporanea delle due arterie carotidi comuni (a livello del collo, approccio sagittale ventrale) (Figg. 58a, 58b).48,49
Si possono in particolare eseguire:1,13,45-47,50,51
ALTRE CHIRURGIE
- Resezioni linguali. Sono possibili (Figg. 64a, 64b). La prognosi dipende dall’istotipo, dalle dimensioni del tumore, dalla sua localizzazione e dalle eventuali metastasi già presenti (specie linfonodi regionali).


- Resezioni coinvolgenti guance e labbra. Dopo escissione “en bloc”, è spesso richiesto il ricorso a procedure ricostruttive speciali per colmare il difetto (lembi di avanzamento o di trasposizione, lembi tubulati, lembi assiali, etc).
- Chirurgie particolari. In casi selezionati e in caso di benignità della lesione è possibile utilizzare per l’osteotomia lo strumentario per TPLO. Tale espediente consente di essere molto meno demolitivi (Figg. 65a, 65b).


Dopo la chirurgia, oltre a sottomettere il/i linfonodo/i regionale/i ad esame istologico (per stadiazione e prognosi), è indispensabile identificare i margini di escissione relativi al tumore primario (ad esempio con inchiostro di china – Fig. 66 - e suture) al fine di valutare istologicamente di aver eseguito una escissione completa.
Gestione post-operatoria
Cibo soffice per os può essere offerto dopo 24-48 ore dall’intervento nella maggior parte dei casi. È sempre opportuno applicare un collare elisabettiano per almeno 1 settimana. La profilassi antibiotica, ad ampio spettro, si protrae in genere per 5-7 giorni. Si sottolinea la opportunità, in caso di resezioni molto estese e/o si preveda qualche complicanza, di applicare al termine dell’intervento un sondino esofageo. In tal caso, nei giorni successivi, la somministrazione di cibo soffice può avvenire sia attraverso il sondino sia per os., fino alla risoluzione del problema (indipendenza del soggetto ad assumere il cibo solo per os.). La somministrazione di cibo soffice si protrae in genere per i primi 2-3 mesi post-intervento.
Complicanze della chirurgia
Le complicanze più frequenti, alcune inevitabili, sono rappresentate da:
- Emorragia intraoperatoria (specie in caso di maxillectomia). Si può prevenire e controllare con legatura delle aa. Carotidi comuni e/o trasfusione di sangue.
- Epistassi post-operatoria (in caso di resezioni mascellari): in genere autolimitante, si risolve in 3-5 giorni.
- Deiscenza della sutura e sviluppo di fistole oro-nasali.
- Infezione: pur trattandosi di una chirurgia per definizione “contaminata”, questo evento è raro.
- Deviazione mandibolare e alterazioni di occlusione.
- Perdita eccessiva di saliva e prolasso della lingua (Fig. 69).

- Epifora per recisione, eliminazione o legatura del dotto nasolacrimale.
- Edema o “falsa ranula” a livello della parte laterale della lingua a seguito di mandibolectomia segmentale, orizzontale, o emimandibolectomia totale (specie nel gatto e, nel cane, per incisioni prossime alla parte ventrale della lingua).
- Ranula (a seguito di resezioni mandibolari orizzontali o rostrali bilaterali dopo il terzo premolare): in genere il problema si risolve in pochi giorni. Utile l’uso di antinfiammatori non steroidei
- Funzione.
- Aspetto estetico.
Nel cane, la resezione “en bloc” a margini puliti può essere curativa in quasi la totalità delle EA e degli ameloblastomi e nella maggior parte dei CS rostrali. In caso di CS aborali (soprattutto tonsillari), la prognosi è negativa e la chirurgia è da considerarsi solo come misura palliativa. La sopravvivenza a 1 anno è del 40-50% in caso di FSA, fino al 70% per l’OSA e fino al 30% dei cani in caso di MM selezionati.
Nel gatto il numero di interventi chirurgici eseguibili è molto più esiguo a motivo sia della notevole aggressività (tumore + infezione) della maggior parte dei CS sia della loro frequente localizzazione a livello della lingua. Comunque, in casi selezionati dove la chirurgia a margini puliti rappresenta un’opzione realistica, la sopravvivenza può essere prolungata. Per gli altri fenotipi neoplastici, i risultati sono simili al cane ma, sfortunatamente, la maggior parte dei gatti è, già in presentazione, spesso non operabile.
Bibliografia
- Liptak J.M. and Withrow S.J. Oral tumors. In Withrow & MacEwewn’sSmall Animal Oncology, Withrow S.J. and Vail D.M. eds., 4th edition, pp 455-475. Philadelphia: Saunders, 2007.
- Brønden LB, Eriksen T, Kristensen AT. Oral malignant melanomas and other head and neck neoplasms in Danish dogs--data from the Danish Veterinary Cancer Registry. Acta Vet Scand 51:54, 2009
- Dubielzig, R.R., Goldschmidt, M.H. & Brodey, R.S. (1979). The nomenclature of periodontal epulides in dogs. Veterinary Patholology 16, 209-214.
- Dubielzig R.R. Proliferative dental and gingival disease of dogs and cats. J Am Anim Hosp Assoc 18:577, 1982
- Thrall D.E. Othovoltage radiotherapy of acanthomatous epulides in 39 dogs. J Am Vet Med Assoc 184:826, 1984.
- Thrall, D.E., Goldschmidt, M.H., Biery, D.N. Malignant tumor formation at the site of previously irradiated acanthomatous epulides in four dogs. Journal of the American Veterinary Medicine Association 178, 127-132, 1981
- Ramos-Vara JA, Beissenherz ME, Miller MA, Johnson GC, Pace LW, Fard A, Kottler SJ. Retrospective study of 338 canine oral melanomas with clinical, histologic, and immunohistochemical review of 129 cases. Veterinary Pathology 37:597-608, 2000.
- Dennis MM, Ehrhart N, Duncan CG, Barnes AB, Ehrhart EJ. Frequency of and risk factors associated with lingual lesions in dogs: 1,196 cases (1995-2004). J Am Vet Med Assoc 228(10):1533-7, 2006
- Owen LN.TNM classification of tumors in domestic animals. Geneva. World Health Organization, 1980.
- Hahn K.A., De Nicola DB, Richardson RC, Hahn EA. Canine oral malignant melanoma: prognostic utility of an alternative staging system. J. Small An. Pract. 35: 251-256, 1994
- Kosovsky JK, Matthiesen DT, Marretta SM et al. Results of partial mandibulectomy for the treatment of oral tumors in 142 dogs. Vet Surg 20: 397-401, 1991
- Page RL,Thrall DE, Dewhrist MW et al. Phase I study of melphalan alone and melphalan plus whole body hyperythermia in dogs with malignant melanoma. Int J Hyperthermia 7:559, 1991
- Wallace J, Matthiesen DT, Patnaik AK. Hemimaxillectomy for the treatment of oral tumors in 69 dogs. Vet Surg 21:337, 1992
- Bateman KE, Catton PA, Pennock PW et al. Radiation therapy for the treatment of canine oral melanoma. J Vet Intern Med 8:267, 1994
- Kitchell BE, Brown DM, Luck EE et al. Intralesional implant for treatment of primary oral malignant melanoma in dogs. JAVMA 204:229, 1994
- Blackwood L, Dobson JM. Radiotherapy of oral malignant melanomas in dogs. JAVMA 209:98, 1996
- ThéonAP, Rodriguez C, Madewell BR. Analysis of prognostic factors and pattern of failure in dogs with malignant oral tumors treated with megavoltage irradiation. JAVMA 210:778, 1997
- Rassnick KM, Ruslander DM, Cotter SM et al. Use of carboplatin for treatment of dogs with malignant melanoma: 27 cases (1989-2000). JAVMA 218:1444, 2001
- Freeman KP, Hahn KA, Harris FD et al. Treatment of dogs with oral melanoma by hypofractionated radiation therapy and platinum-based chemotherapy (1987-1997). J Vet Intern Med 17:96, 2003
- Kudnig ST, Ehrhart N, Withrow SJ et al. Survival analysis of oral melanoma in dogs. Veterinary Cancer Society Proc 23:39, 2003
- Proulx DR, Ruslander DM, Dodge RK et al. A retrospective analysis of 140 dogs with oral melanoma treated with external beam radiation. Vet Radiol Ultrasound 44:352, 2003
- Boria PA, Murry DJ, Bennet PF et al. Evaluation of cisplatin combined with piroxicam for the treatment of oral malignant melanoma and oral squamous cell carcnoma in dogs. JAVMA 224:388, 2004
- Murphy S, Hayes AM, Blackwood L, Maglennon G, Pattinson H, Sparkes AH (2005) Oral malignant melanoma - the effect of coarse fractionation radiotherapy alone or with adjuvant carboplatin therapy. Vet Comp Oncol 3, 222-229
- Bergman PJ, McKnight J, Novosad A, Charney S, Farrelly J, Craft D, Wulderk M, Jeffers Y, Sadelain M, Hohenhaus AE, Segal N, Gregor P, Engelhorn M, Riviere I, Houghton AN, Wolchok JD.Long term survival of dogs with advanced malignant melanoma after DNA vaccination with xenogeneic human thyrosinase: a phase II trial. Clin Cancer Res 9:1284, 2003
- Bergman PJ, Camps-Palau MA, McKnight JA et al. Develpoment of a xenogeneic DNA vaccine program for canine malignant melanoma for prolongation of survival in dogs with locoregionally controller stage II-III disease. Vet Cancer Soc Proc 23:40, 2003a
- Bergman PJ, Wolchok JD. Of Mice and Men (and Dogs): development of a xenogeneic DNA vaccine for canine oral malignant melanoma. Cancer Therapy 6: 817-826, 2008
- Liao JC, Gregor P, Wolchok JD, Orlandi F, Craft D, Leung C, Houghton AN, Bergman PJ. Vaccination with human tyrosinase DNA induces antibody responses in dogs with advanced melanoma. Cancer Immun 6:8, 2006
- de Vos JP, Burm AG, Focker AP, Boschloo H, Karsijns M, van der Waal I. Piroxicam and carboplatin as a combination treatment of canine oral non-tonsillar squamous cell carcinoma: a pilot study and a literature review of a canine model of human head and neck squamous cell carcinoma. Vet Comp Oncol 3(1):16-24, 2005.
- Bertone ER, Synder LA, Moore AS, et al. Environmental and lifestyle risk factors for oral squamous cell carcinoma in domestic cats. J Vet Intern Med 17:557, 2003
- Hutson CA, Willaeur CC, Walder EJ et al. Treatment of mandibular squamous cell carcinoma in cats by use of mandibulectomy and radiotherapy: seven cases (1987-1989). J Am Vet Med Assoc 201:777, 1992
- Ciekot PA, Powers BE, Withrow SJ et al. Histologically low grade yet biologically high grade fibrosarcomas of the mandible and maxilla of 25 dogs 1982-1991). J Am Vet Med Assoc 204:610, 1994
- Todoroff RJ, Brodey RS. Oral and pharingeal neoplasia in the dog: a retrospective survey of 361 cases. JAVMA 175: 567-571, 1979.
- Schwartz, P.D., Withrow, S.J., Curtis, C.R., Powers, B.E. & Straw, R.S. Mandibular resection as a treatment for oral cancer in 81 dogs. J Am Anim Hosp Assoc 27, 601-610, 1991.
- Straw, R.C., Powers, B.E., Klausner, K., Henderson, R.A., Morrison, W.B., McCaw, D.L., Harvey, H.J., Jacobs, R.M., & Berg, R.J. Canine mandibular osteosarcoma: 51 cases (1980-1992). Journal of the American Animal Hospital Association 32, 257-262, 1996.
- Stokking LB, Ehrhart EJ, Lichtensteiger CA, Campbell KL. Pigmented epidermal plaques in three dogs. J Am Anim Hosp Assoc 40(5):411-7, 2004.
- Dubielzig, R.R. & Thrall, D.E. Ameloblastoma and keratinizing ameloblastoma in dogs. Veterinary Pathology 19, 596-607, 1982.
- Turk MAM, Johnson GC, Gallina AM. Canine granular cell tumour (myoblastoma): a report of four cases and review of the literature. J Sm Anim Pract 24:637, 1983
- Straw RC, LeCouteur RA, Powers BE, et al. Multilobular osteochondrosarcoma of the canine skull: 16 cases (1978-1988). J Am Vet Med Assoc 195:1764, 1989
- Dernell WS, Straw RC, Cooper MF, et al. Multilobular osteochondrosarcoma in 39 dogs: 1979-1993. J Am Anim Hosp Assoc 34:11, 1998
- Potter KA, Tucker RD, Carpenter JL. Oral eosinophilic granuloma of Siberian huskies. J An Anim Hosp Assoc 16:595, 1980
- Madewell BR, Stannard AA, Pulley LT, et al. Oral eosinophilic granuloma in Siberian husky dogs. J Am Vet Med Assoc 177:701, 1980
- Bredal WP, Gunnes G, Vollset I, et al. Oral eosinophilic granuloma in three Cavalier King Charles spaniels. J Sm Anim Pract 37:499, 1996
- Withrow, S.J., & Holmberg, D.L. Mandibulectomy in the treatment of oral cancer. Journal of the American Animal Hospital Association 19, 273-286, 1983
- Salisbury, S.K., Richardson, D.C. & Lantz, G.C. Partial maxillectomy and premaxillectomy in the treatment of oral neoplasia in the dog and cat. Veterinary Surgery15, 16-26, 1986
- Birchard, S. & Carothers, M. Aggressive surgery in the management of oral neoplasia. Veterinary Clinics of North America: Small Animal Practice 20, 1117-1140, 1990
- White, R.A.S. Mandibulectomy and maxillectomy in the dog: long term survival in 100 cases. Journal of Small Animinal Practice 32, 69-74, 1991
- Verstraete FJM. Mandibulectomy and maxillectomy. Vet Clin Small Anim, 35:1009-1039, 2005
- Clendenin, M.A. & Conrad, M.C. Collateral vessel development after chronic bilateral common carotid artery occlusion in the dog. American Journal of Veterinary Research 40, 1244-1248, 1979
- Hedlund, C.S., Tangner, C.H., Elkins, A.D. Temporary bilateral carotid artery occlusion during surgical exploration of the nasal cavity of the dog. Veterinary Surgery 12, 83-85, 1983
- Withrow, S.J., Nelson, A.W., Manley, P.A. & Biggs, D.R. Premaxillectomy in the dog. Journal of the American Animal Hospital Association 21, 49-55, 1985
- Salisbury, S.K. & Lantz, G.C. Long-term results of partial mandibulectomy for treatment of oral tumors in 30 dogs. Journal of the American Animal Hospital Association 24, 285-294, 1988.
- Yoshida K, Watarai Y, Sakai Y, Yanai T, Masegi T, Iwasaki T. The effect of intralesional bleomycin on canine acanthomatous epulis.J Am Anim Hosp Assoc.34:457-61, 1998
- Kelly JM, Belding BA, Schaefer AK. Acanthomatous ameloblastoma in dogs treated with intralesional bleomycin. Vet Comp Oncol 8:81-6, 2010
- Reed SD, Fulmer A, Buckholz J, Zhang B, Cutrera J, Shiomitsu K, Li S. Bleomycin/interleukin-12 electrochemogenetherapy for treating naturally occurring spontaneous neoplasms in dogs. Cancer Gene Ther.17:571-8, 2010